Lehrbuch Lyme-Borreliose
22.3 |
Serologie im Spätstadium |
In verschiedenen Meinungspublikationen wird behauptet, dass bei der Lyme-Borreliose im Stadium III (Spätstadium) grundsätzlich Antikörper nachweisbar seien, d.h. bei einer Lyme-Borreliose III
bestünde stets Seropositivität.
Andererseits belegen zahlreiche Publikationen und Fallstudien, dass bei der Lyme-Borreliose im Stadium III bis zu 50% der Patienten keine Antikörper aufweisen, es besteht also bei der Hälfte der
Patienten Seronegativität (1-18).
Unter Bezugnahme auf vorrausgehende Publikationen stellen Wang und Hilton, 2001 (29) fest, dass ein geringer Anteil von Patienten bei einer Infektion mit Borrelia burgdorferi keine Antikörper
entwickeln. Dabei zeigte sich eine Korrelation mit dem Humanen Leukozyten Antigenen (HLA) der Klasse II. Nachgewiesen wurde eine Korrelation zwischen Seronegativität und HLA-DR1, bei
Seropositivität eine Beziehung zu HLA-DR7. Die Ergebnisse legen also nahe, genetisch determinierte immunologische Faktoren in Zusammenhang mit der Seronegativität zu diskutieren.
IgM-Antikörper kommen sowohl in der Frühphase als auch in der Spätphase höchstens in 50% der Fälle vor. Die Angaben in der Literatur sind etwas widersprüchlich. Entscheidend ist jedoch, dass
IgM-AK lediglich die stattgehabte Infektion beweisen; das Fehlen von IgM AK schließt die Infektion nicht aus. In der Spätphase spricht das Vorliegen von IgM-Antikörpern keinesfalls für eine
„aktive Lyme-Borreliose“. Das Auftreten von IgM-AK im Spätstadium (Stadium III) beweist auch nicht eine sogenannte Reinfektion, da IgM-Antikörper über Jahrzehnte persistieren können.
In MiQ 12, Qualitätsstandards in der mikrobiologisch - infektiologischen Diagnostik im Auftrag der deutschen Gesellschaft für Hygiene und Mikrobiologie (DGHM) (32) wird behauptet, dass „ein
isoliert positiver IgM - Befund (bei negativem IgG - Befund) gegen die Diagnose einer Spätmanifestation der Lyme-Borreliose spricht. Diese Behauptung ist unzutreffend und durch Literatur nicht
belegbar. Entsprechend enthält diese Passage im MiQ auch keine Literaturhinweise. Die Autoren des MiQ 12 behaupten, dass ein falsch positiver IgM-Nachweis im Rahmen einer infektiösen Mononucleose
oder eventuell auch anderer Herpesvirus-Infektionen bedingt sein könne. Auch bei Autoimmunerkrankungen und Erkrankungen des rheumatischen Formenkreises sei mit falsch positiven (zum Teil Test
bedingten) IgM-Befunden zu rechnen. In vielen Fällen würde die Ursache solcher IgM-Befunde unklar bleiben. Andererseits wird im MiQ 12 aufgeführt, dass durch Verwendung von Test der 2. oder 3.
Generation falsch positive Befunde deutlich seltener geworden seien. Falsch positive Befunde ergäben sich insbesondere im Hinblick auf die Syphilis, das Rückfallfieber, Herpesvirus Infektionen,
insbesondere Epstein-Barr-
Virus sowie Autoimmunerkrankungen und Erkrankungen des rheumatischen Formenkreises. Es sei zu empfehlen, solche Tests zu verwenden, die falsch positive Reaktionen weitgehend vermeiden (Test der
2. und 3. Generation). Aus diesen Darstellungen im MiQ 12 ergibt sich also keineswegs, dass ein isoliert positiver IgM-Befund gegen eine Spätmanifestation der Lyme-Borreliose spricht. Bei
Anwendung moderner serologischer Testverfahren und bei Beachtung der oben aufgeführten differentialdiagnostisch zu beachtenden Erkrankungen ist ein falsch positiver IgM-AK praktisch
auszuschließen. Entscheidend ist jedoch die Tatsache, dass in der Literatur das isolierte Vorkommen von IgM-AK im Spätstadium der Lyme-Borreliose beschrieben ist (1,30,31,32).
Repräsentativ für die Behauptung, dass bei der Lyme-Borreliose im Spätstadium stets Seropositivität vorläge, ist die Arbeit von Wilske et al., 2007 (19). In dieser Publikation heißt es: „In der
Spätphase der Lyme-Borreliose (Acrodermatitis, Arthritis) sind AK bei allen Patienten nachweisbar (Hansen und Asbrink, 1989; Wilske et al., 1993).
Diese beiden zugrunde gelegten Publikationen werden epikritisch dargestellt und kommentiert. Der Vollständigkeit halber wird zudem die Arbeit von Goettner et al., 2005 einbezogen. Der Nachweis,
dass bei der Acrodermatitis chronica atrophicans stets IgG-AK nachweisbar sind, war bereits in vorausgehenden Studien festgestellt worden (26-28).
Hansen K und Asbrink E, 1989 (20)
Die Publikation aus 1989 vergleicht die Sensitivität von ELISA-Tests bei Einsatz von 2 verschiedenen Antigenen:
- „sonic extract“ ELISA
- Flagellum ELISA
Der Flagellum ELISA ist sensitiver als der „sonic extract“ ELISA.
Bei Erythema migrans (EM) liegt die Sensitivität des Flagellum ELISA IgG bei 36%, für IgM bei 45%. Bei Dauer des EM von einem Monat oder länger beträgt die IgG-Sensitivität 50%.
Bei Patienten mit ACA waren in allen Fällen IgG-AK nachweisbar.
IgM-AK stellt einen unspezifischen Befund bei Patienten mit ACA dar.
Flagellum ELISA ist von Bedeutung bei der wachsenden Routineserologie bei LB.
Stellungnahme d. Verf.
Im Hinblick auf den Aspekt Serologie bei Lyme-Borreliose Stadium III ist also zu beachten, dass eine positive Serologie
nur bei Patienten mit ACA regelmäßig nachweisbar war, während ohne diese Hautmanifestation Seronegativität häufig beschrieben wird. Es kann also nicht ausgeschlossen werden, dass Patienten mit
ACA immunologisch anders reagieren als Patienten mit Lyme-Borreliose Stadium III ohne ACA. In den oben angesprochenen Publikationen (1-18) über Seronegativität bei Lyme-Borreliose Stadium III
wurde häufig der Krankheitserreger nachgewiesen. Da sowohl ACA als auch Erregernachweis als Beweis für die Lyme-Borreliose im Stadium III gelten, können sich nur 2 Schlussfolgerungen ergeben:
- Bei ACA Seropositivität
- Bei Lyme-Borreliose Stadium III ohne ACA häufig Seronegativität
Die Gleichsetzung von ACA und Lyme-Borreliose Stadium III ohne ACA lässt sich literarisch nicht belegen.
In diesem Zusammenhang ist auch das Verhältnis eines länger dauernden Erythema migrans/Serologie von Bedeutung. Auch das Erythema migrans gilt als krankheitsbeweisend. In der Arbeit von Hansen und Asbrink, 1989 war das EM von einem Monat oder länger jedoch nur in 50% der Fälle mit einem pathologischen Befund für IgG-AK verbunden.
Wilske B et al., 1993 (21)
Die Publikation vergleicht Immunoblot/IFA bzw. ELISA.
Immunoblot: Antigene: p100, Flagellin, internes Flagellin, OspA, OspC.
Vergleich mit folgenden Suchtests:
- IFA-ABS
- Flagellin ELISA
- ELISA (OGP-ELISA)
Die Publikation schließt 24 Patienten mit Lyme-Arthritis (Arthritis im Spätstadium) und 19 Patienten mit ACA ein. Bei all diesen Patienten waren IgG-ELISA und p100 (Immunoblot, IgG) positiv (vgl. Tab. 22.7).

Stellungnahme d. Verf.
Zu beachten ist, dass im Immunoblot nur die Bande p100 in 100% der Fälle nachweisbar war, während andere Banden nur relativ selten vorkamen. Eine solche Konstellation ist aus heutiger Sicht
ungewöhnlich; zu beachten ist zudem, dass die Publikation aus 1993 stammt, also wahrscheinlich Patienten aus vorausgehenden Jahren betrifft. Zu jener Zeit waren die Methoden zur serologischen
Untersuchung bei LB noch begrenzt. – Ungewöhnlich auch der hohe Prozentsatz bei der (unspezifischen) Bande 41 (Patienten 100%, Kontrollen 71%). Die Einschlusskriterien werden in der Publikation
nicht eindeutig definiert. Ob bei der Einbeziehung der Patienten mit ACA bzw. Lyme-Arthritis auch der serologische Befund eine Rolle spielte, geht aus der Publikation nicht hervor; es wird
lediglich festgestellt, dass Patienten mit Lyme-Arthritis bzw. ACA einbezogen wurden.
Goettner et al., 2005 (25)
In der methodologischen Studie von Goettner et al. (25) zur Verbesserung des Immunoblots sind jeweils 10 Patienten mit Acrodermatitis chronica atrophicans bzw. Lyme-Arthritis enthalten. Bei all
diesen Patienten war die Serologie (Immunoblot, IgG) positiv (vgl. Tab. 22.8).

Stellungnahme d. Verf.
In Übereinstimmung mit den schon besprochenen Publikationen (20, 21) wurde auch in der Arbeit von Goettner et al., 2005 bei ACA und Lyme-Arthritis Seropositivität festgestellt und zwar im
IgG-Immunoblot. Zu beachten ist, dass es sich um eine methodologische Studie handelt, die nicht darauf ausgelegt war, die Häufigkeit von serologischen Befunden bei der Lyme-Borreliose im Stadium
III zu analysieren. Darüber hinaus war die Anzahl einbezogener Patienten mit ACA bzw. Lyme-Arthritis sehr gering. Auch bleibt unklar, welche Einschlusskriterien für die Lyme-Borreliose im Stadium
III galten. In der Studie heißt es lediglich, dass jeweils 10 Patienten mit ACA bzw. Lyme-Arthritis einbezogen wurden. Inwieweit bei dieser Einbeziehung auch der serologische Befund eine Rolle
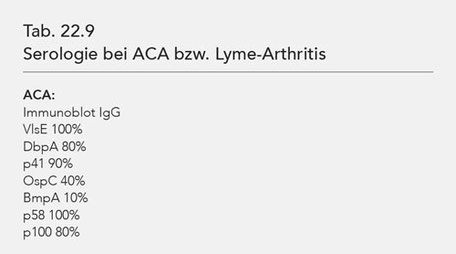
spielte, geht aus der Publikation nicht hervor. Auffallend ist, dass im Gegensatz zu der Arbeit von Wilske et al., 1993 (21) die Bande p100 bei ACA nur bei 80% und bei Lyme-Arthritis bei 90%
nachweisbar war. Dagegen war in der Studie von Goettner et al. nur die Bande VlsE zu 100% sowohl bei ACA als auch bei Lyme-Arthritis nachweisbar. Die Studie von Wilske et al. (21) enthält nicht
die Bande VlsE, da dieses Antigen zum damaligen Zeitpunkt der Studie noch nicht zur Verfügung stand.
Fazit d. Verf.
Die Arbeit von Wilske et al., 2007, stellt keine Studie dar. Vielmehr bezieht sich diese Meinungspublikation auf die Studie von Hansen und Asbrink, 1989 sowie Wilske et al., 1993. Die Studie von
Hansen und Asbrink betrifft methodische Fragen des ELISA-Tests zum Nachweis von Antikörpern. In dieser Publikation wird festgestellt, dass bei der Lyme-Borreliose im Stadium III häufig
Seronegativität besteht.
Auch die Arbeit von Wilske et al., 1993 befasst sich mit methodischen Fragen des Antikörper-Nachweises. Entsprechend der Konzeption der Arbeit, insbesondere der Einschlusskriterien, macht diese
Studie keine Aussage über die Häufigkeit von Seropositivität bei Lyme-Borreliose im Spätstadium (Stadium III) generell, sondern nur bei ACA und Lyme-Arthritis.
Entscheidend ist jedoch, dass zahlreiche andere Publikationen vorliegen, bei denen die Häufigkeit von Antikörpern bei der Lyme-Borreliose im Stadium III überprüft wurde mit dem Ergebnis, dass
Seronegativität bei der Lyme-Borreliose im Stadium III häufig vorkommt.
In der Arbeit von Asch et al. (22) waren die 4 Patienten mit intermittierender Arthritis alle seropositiv, dagegen bestand bei den übrigen 119 Patienten mit Lyme-Borreliose im Spätstadium
Seronegativität in 69% der Fälle. In der Arbeit von Tylewska-Wierzbanowska und Chmielewski (4) wurden bei 11 Patienten mit Lyme-Arthritis nur in etwa 30% der Fälle spezifische Banden im
Immunoblot IgG nachgewiesen. Hassler (23) fand bei der Lyme-Arthritis Seronegativität, allerdings war die Seropositivität bei Vorliegen einer Lyme-Arthritis achtmal größer als bei Patienten mit
Lyme-Borreliose Stadium III ohne Arthritis (23). – Andererseits berichtet Hassler über 166 Patienten, die im Laufe von 3 Jahren mindestens einmal eine Episode einer Lyme-Arthritis aufwiesen. Von
diesen Patienten waren 95 seronegativ und 71 seropositiv, entsprechend 55% seronegativ und 45% seropositiv. – Klemann und Huismans untersuchten 105 Patienten, bei denen die Diagnose
Lyme-Borreliose Stadium III durch Erregernachweis gesichert wurde; dabei ergaben sich positive Befunde für IgG ELISA in 47% und IgG Westernblot in 58%. Für IgM betrugen die Werte 12% bzw. 15%; in
über 40% der Fälle lag also Seronegativität vor (24).
Die Behauptung von Wilske et al. (19), dass bei einer Lyme-Borreliose im Stadium III stets Seropositivität vorläge, stützt sich also ausschließlich auf die Arbeit von Hansen und Asbrink (20) und
Wilske et al. (21). Die Literatur enthält jedoch zahlreiche andere Publikationen, die der Ansicht von Wilske entgegenstehen und belegen, dass bei der Lyme-Borreliose Stadium III Seronegativität
häufig vorkommt (vgl. Kap. 22.4).
Die oben kommentierten 3 Publikationen (20, 21, 25) stellen methodologische Studien dar. Aufgrund ihrer Konzeption tragen sie zu Beurteilung der Häufigkeit von Seronegativität bzw. -positivität bei der Lyme-Borreliose im Stadium III nicht bei. Dabei ist zu beachten, dass die in den Studien insbesondere angesprochenen Krankheitsmanifestationen einer Acrodermatitis chronica atrophicans und einer Lyme-Arthritis nur in einem Teil der Fälle bei Lyme-Borreliose im Stadium III vorkommen und zwar mit einer Häufigkeit bei ACA von 10%, bei Lyme-Arthritis von 40%.
- Literaturverzeichnis
-
- Kalish RA, McHugh G, Granquist J, Shea B, Ruthazer R, Steere AC. Persistence of immunoglobulin M or immunoglobulin G antibody responses to Borrelia burgdorferi 10-20 years after active Lyme disease. Clin Infect Dis. 2001; 33(6):780-5.
- Klempner MS, Hu LT, Evans J, Schmid CH, Johnson GM, Trevino RP, Norton D, Levy L, Wall D, McCall J, Kosinski M, Weinstein A. Two controlled trials of antibiotic treatment in patients with persistent symptoms and a history of Lyme disease. N Engl J Med. 2001; 345(2):85-92.
- Dejmková H, Hulínska D, Tegzová D, Pavelka K, Gatterová J, Vavrík P. Seronegative Lyme arthritis caused by Borrelia garinii. Clin Rheumatol. 2002; 21(4):330-4.
- Tylewska-Wierzbanowska S und Chmielewski T. Limitation of serological testing for Lyme borreliosis: evaluation of ELISA and western blot in comparison with PCR and culture methods. Wien Klin Wochenschr. 2002; 114(13-14):601-5.
- Breier F, Khanakah G, Stanek G, Kunz G, Aberer E, Schmidt B, Trappeiner G. Isolation and polymerase chain reaction typing of Borrelia afzelii from a skin lesion in a seronegative patient with generalized ulcerating bullous lichen sclerosus et atrophicus. Br J Dermatol. 2001; 144(2):387-92.
- Wang P und Hilton E. Contribution of HLA alleles in the regulation of antibody production in Lyme disease. Front Biosci. 2001; 6:B10-6.
- Grignolo MC, Buffrini L, Monteforte P, Rovetta G. [Reliability of a polymerase chain reaction (PCR) technique in the diagnosis of Lyme borreliosis]. Minerva Med. 2001; 92(1):29-33.
- Honegr K, Hulínská D, Dostál V, Gebousky P, Hankova E, Horacek J, Vyslouzil L, Havlasova J. [Persistence of Borrelia burgdorferi sensu lato in patients with Lyme borreliosis]. Epidemiol Mikrobiol Imunol. 2001; 50(1):10-6.
- Eldøen G, Vik IS, Vik E, Midgard R. [Lyme neuroborreliosis in More and Romsdal]. Tidsskr Nor Laegeforen. 2001; 121(17): 2008-11.
- Wilke M, Eiffert H, Christen HJ, Hanefeld F. Primarily chronic and cerebrovascular course of Lyme neuroborreliosis: case reports and literature review. Arch Dis Child. 2000; 83(1):67-71.
- Bertrand E, Szpak GM, Piłkowska E, Habib N, Lipczynska-Lojkowska W, Rudnicka A, Tylewska-Wierzbanowska S, Kulczycki J. Central nervous system infection caused by Borrelia burgdorferi. Clinico-pathological correlation of three post-mortem cases. Folia Neuropathol. 1999; 37(1):43-51.
- Oksi J, Marjamäki M, Nikoskelainen J, Viljanen MK. Borrelia burgdorferi detected by culture and PCR in clinical relapse of disseminated Lyme borreliosis. Ann Med. 1999; 31(3):225-32.
- Aberer E, Kersten A, Klade H, Poitschek C, Jurecka W. Heterogeneity of Borrelia burgdorferi in the skin. Am J Dermatopathol. 1996; 18(6):571-9.
- Luft BJ, Dattwyler RJ, Johnson RC, Luger SW, Bosler EM, Rahn DW, Masters EJ, Grunwaldt E, Gadgil SD. Azithromycin compared with amoxicillin in the treatment of erythema migrans. A double-blind, randomized, controlled trial. Ann Intern Med. 1996; 124(9):785-91.
- Mursic VP, Wanner G, Reinhardt S, Wilske B, Busch U, Marget W. Formation and cultivation of Borrelia burgdorferi spheroplast-L-form variants. Infection. 1996; 24(3):218-26.
- Coyle PK, Schutzer SE, Deng Z, Krupp LB, Belman AL, Benach JL, Luft BJ. Detection of Borrelia burgdorferi-specific antigen in antibody-negative cerebrospinal fluid in neurologic Lyme disease. Neurology. 1995; 45(11):2010-5.
- Häupl T, Hahn G, Rittig M, Krause A, Schoerner C, Schönherr U, Kalden JR, Burmester GR.Persistence of Borrelia burgdorferi in ligamentous tissue from a patient with chronic Lyme borreliosis. Arthritis Rheum. 1993; 36(11):1621-6.
- Nadelman RB, Pavia CS, Magnarelli LA, Wormser GP. Isolation of Borrelia burgdorferi from the blood of seven patients with Lyme disease. Am J Med. 1990; 88(1):21-6.
- Wilske B, Fingerle V, Schulte-Spechtel U. Microbiological and serological diagnosis of Lyme borreliosis. FEMS Immunol Med Microbiol. 2007; 49:13-21.
- Hansen K und Asbrink E. Serodiagnosis of erythema migrans and acrodermatitis chronica atrophicans by the Borrelia burgdorferi Flagellum enzyme-linked immunosorbent assay. J Clin Microbiol. 1989; 27(3):545-41.
- Wilske B, Fingerle V, Herzer P, Hofmann A, Lehnert G, Peters H, Pfister HW, Preac-Mursic V, Soutschek E, Weber K. Recombinant immunoblot in the serodiagnosis of Lyme borreliosis. Comparison with indirect immunofluorescence and enzyme-linked immunosorbent assay. Med Microbiol Immun. 1993; 182/5):255-70.
- Asch ES, Bujak DI, Weiss M, Peterson MGE, Weinstein A. Lyme Disease: An Infectious and Postinfectious Syndrome. The Journal of Rheumatology. 1994; 21:3.
- Hassler D. Langzeitbeobachtungen zum Krankheitsbild der Lyme-Borreliose in einem Endemiegebiet: Daten zur Vektorökologie, Epidemiologie, Serologie und Klinik, Therapie und Therapiekontrolle. Hygiene-Institut der Universität Heidelberg. 1997.
- Klemann W und Huismans BD. Patienten mit Erreger-Direktnachweis bei chronischer Lyme-Borreliose: Klinik, Labordiagnostik, Antibiotika-Therapie und Krankheitsverlauf; Umwelt-Medizin-Gesellschaft; 22. Jahrgang, 2/2009, S. 132-138.
- Goettner A, Schulte-Spechtel U, Hillermann R, Liegl G, Wilske B, Fingerle V. Improvement of Lyme Borreliosis Serodiagnosis by a Newly Developed Recombinant Immunoglobulin G (IgG) and IgM Line Immunoblot Assay and Addition of VlsE and DbpA Homologues. Journal of Clinical Microbiology. 2005; 3602–3609.
- Ackermann R, Boisten HP, Kabatzki J, Runne U, Krüger K, Hermann WP. Serumantikörper gegen Ixodes-ricinus-Spirochäte bei Acrodermatitis chronica atrophicans (Herxheimer). DMW Originalien. 1984, 109(1):6-10.
- Neubert U, Krampitz HE, Engl H. Microbiological Findings in Erythema (Chronicum) Migrans and Related Disorders. Zbl Bakt Hyg A. 1986; 263:237-252.
- Brehmer-Andersson E, Hovmark A, Åsbrink E. Acrodermatitis Chronica Atrophicans: Histopathologic Findings and Clinicla Correlations in 111 Cases. Acta Derm Venerol (Stockh). 1998; 78: 207-213.
- Wang P und Hilton E. Contribution of HLA alleles in the regulation of antibody production in Lyme disease. Front Biosci. 2001, 6:B10-6.
- Lomholt H,, Lebech AM, Hansen K, Brandrup F, Halkier-Sørensen L. Long-term serological follow-up of patients treated for chronic cutaneous borreliosis or culture-positive erythema migrans. Acta Derm Venereol, 2000 Sep-Oct; 80(5): 362-6.
- Berardi VP, Weeks KE, Steere AC. Serodiagnosis of early Lyme disease: analysis of IgM and IgG antibody response by using an antibody-capure enzyme immunoassay. J Infect Dis, 1988 Oct; 158(4): 754-60.
- MiQ 12: Lyme-Borreliose, Qualitätstandards in der mikrobiologisch-infektiologischen Diagnostik. Mauch H (Herausgeber), Lütticken R (Herausgeber), Wilske B et al. (Autor). Urban & Fischer Verlag/Elsevier GmbH 2000.