Lehrbuch Lyme-Borreliose
23.1 |
Abwehr der Antibiose durch Bb |
Die Effizienzfaktoren bei der antibiotischen Behandlung der Lyme-Borreliose werden detailliert im Kap. 23 „Antibiotische Therapie der LB“ dargestellt. Abwehrmechanismen von Borrelia burgdorferi (Bb) gegen das humane Immunsystem (vgl. Kap. 23.2) sind zum Teil auch gegen die Antibiose gerichtet.

Die wesentlichen Handicaps der antibiotischen Behandlung bei LB sind in Tab. 23.13 dargestellt.
Antibiotika können von vornherein gegenüber Bb unwirksam sein, d.h. Bb hat gegenüber bestimmten Antibiotika eine natürliche Resistenz. Die Einzelheiten sind in Kap. 23 dargestellt.
Das generelle Problem der Antibiotikaresistenz betrifft (selbstverständlich) auch B. burgdorferi. Die genetischen und molekularbiologischen Zusammenhänge sind zum Teil jedoch bei weitem nicht
erforscht. Bei experimentell hergestellten Mutanten von Bb zeigte sich die antibiotische Resistenz insbesondere bei den antibiotischen Zielen Topoisomerase und Ribosome. Diskutiert wird auch eine
Übertragung der Antibiotikaresistenz in Bb-Kulturen mittels horizontalem Gentransfer (HGT). Der HGT wird möglicherweise durch Bakteriophagen vermittelt, die gewissermaßen als „Shuttle“ für
genetische und molekularbiologische Faktoren der Antibiotikaresistenz fungieren (37).
Bisherige Studien über die Wirksamkeit von Antibiotika bzw. der Antibiotikaresistenz bei B. burgdorferi stützen sich im Wesentlichen auf in-vitro-Untersuchungen an einer vergleichsweise kleinen
Zahl von Borrelien-Isolaten. Aufgrund methodischer Unterschiede ergeben sich zudem erhebliche Diskrepanzen bei den Studien über die Wirksamkeit verschiedener Antibiotika. Entsprechend werden sehr
unterschiedliche Daten zur minimalen inhibitorischen Konzentration (MIC) bzw. zur minimalen bakteriziden Konzentration (MBC) in der Literatur angegeben. Insbesondere fehlen auch ausreichende
Untersuchungen an Borrelien-Isolaten, die von Patienten mit Therapieresistenz stammen. Jüngere in-vitro-Untersuchungen zeigen, dass die klinisch üblicherweise eingesetzten Antibiotika insgesamt
nicht in der Lage sind, B. burgdorferi ausreichend zu eradizieren. Nur bei einer Kombination ungewöhnlicher Antibiotika gelang die Eradikation. Die in diesen Experimenten eingesetzten Antibiotika
kommen jedoch klinisch nicht zur Anwendung (41). Das Gramnegative Bakterium B. burgdorferi unterscheidet sich in seiner antibiotischen Suszeptibilität gegenüber anderen Gramnegativen Bakterien.
Bei den Chinolonen ist im Wesentlichen nur Gemifloxacin wirksam, wahrscheinlich aufgrund eines stärkeren zytotoxischen Effekts und einer stärkeren Hemmung der DNA-Gyrase. Das Ketolid
Telithromycin hat im Vergleich zu den klassischen Makroliden eine erhöhte antibakterielle Potenz, offensichtlich durch eine vergleichsweise hohe Affinität zu den bakteriellen Ribosomen.
In-vivo-Studien über die Wirksamkeit von Gemifloxacin und Telithromycin stehen noch aus. Bisher ungeklärt ist auch die Diskrepanz der in-vitro- vs. in-vivo-Wirkung von Antibiotika bei der
Lyme-Borreliose. Therapiefehler wurden für praktisch alle in Betracht kommenden Antibiotika bei LB nachgewiesen. Beim Erythema migrans waren Antibiotika in vivo unwirksam, obwohl der mittels
Hautbiopsie gewonnene und kulturell angezüchtete Erreger in vitro auf das eingesetzte Antibiotikum reagierte (38).
Wie generell bei der Antibiotikaresistenz spielen auch bei Borrelia burgdorferi MDR („Multi Drug Resistence“)-Effluxpumpen eine wesentliche Rolle. Sie transportieren eingedrungene Antibiotika aus dem Bakterienkörper wieder heraus und zwar aus dem endoplasmatischen und periplasmatischen Raum. Nach Elimination stellt die äußere Membran ein erhebliches Hindernis für das Wiedereindringen des Antibiotikums dar (39).
Über eine Resistenzentwicklung unter antibiotischer Behandlung liegt keine Literatur vor. Nach ärztlicher Erfahrung (d. Verf.) kann eine zunächst wirksame antibiotische Behandlung im
Therapieverlauf ihre Wirkung verlieren. Auch wird beobachtet, dass sich unter antibiotischer Behandlung ein Symptom einer Lyme-Borreliose bessert, ein anderes aber während der Antibiose erstmalig
auftritt. Wie bei vielen anderen Infektionskrankheiten muss also auch bei Bb mit einer Resistenzentwicklung gegenüber der antibiotischen Behandlung gerechnet werden.
Die Dosierung der Antibiotika erfolgt im Rahmen der therapeutischen Breite. Hieraus resultiert, dass einige Antibiotika sehr hohe Gewebskonzentrationen erreichen, andere dagegen nicht (vgl. Tab.
23.14). Die unterschiedlichen Eigenschaften der Antibiotika haben besondere Bedeutung im Hinblick auf gering durchblutete Kompartimente wie Gelenkkapseln, Sehnen, Faszien, extrazelluläre Matrix;
zu solchen Geweben hat Bb eine hohe Affinität.
Die erzielbaren Serumkonzentrationen verschiedener Antibiotika und die antibiotische Effizienz (MIC) sind in Tab. 23.14 dargestellt. Folgende Antibiotika erreichen nur grenzwertige
Konzentrationen: Augmentan, Amoxicillin, Doxycyclin, Tetracycline, Cefuroxim und Penicillin.
Bekanntlich ist Doxycyclin das Mittel der Wahl zur Behandlung der LB im Frühstadium. Diese günstige Wirkung beruht auf der Tatsache, dass sich die Infektion im Bereich der Haut (Erythema migrans)
als gut durchblutete Körperregion abspielt und dass Bb zu diesem frühen Zeitpunkt der Infektion noch nicht das volle Arsenal zur Abwehr von Immunsystem und Antibiose entwickelt hat. Die
Antibiotika Doxycyclin, Cefuroxim und Amoxicillin besitzen im Frühstadium eine ausreichende Wirkung und sind somit zur Behandlung des Frühstadiums, nicht aber des Spätstadiums geeignet. Wegen
relativ rascher Elimination ist Doxycyclin zweimal täglich zu applizieren (vgl. Abb. 23.1). Azithromycin, das auch im Frühstadium eingesetzt wird, erreicht gegenüber den genannten anderen
Antibiotika vergleichsweise hohe Konzentrationen (vgl. Tab. 23.14) und ist daher in der Übergangsphase zur Dissemination vorzuziehen.
Es ist davon auszugehen, dass ein beachtlicher Teil von Bb sich intrazellulär aufhält (7, 8, 9, 10, 11, 12, 13, 14, 15, 16). Daher ist bei der Behandlung der Lyme-Borreliose grundsätzlich der Einsatz von intrazellulär wirksamen Antibiotika gefordert, allerdings nur im Spätstadium (Stadium III). Bezüglich der Einzelheiten sei auf die Tab. 23.15 verwiesen.

Experimentell ist nachgewiesen, dass der intrazelluläre Aufenthalt Bb vor Antibiotika schützt (vgl. Kap. 23.2).
Wegen unterschiedlichen Eliminationszeiten weisen die Antibiotika Unterschiede bei der zeitabhängigen Gewebskonzentration auf. Dieser Faktor bestimmt die Applikationshäufigkeit. In Abb. 23.1 sind am Beispiel von Doxycyclin und Amoxicillin die zeitabhängigen Serumkonzentrationen dargestellt. Es ist erkennbar, dass Amoxicillin 3 x täglich und Doxycyclin 2 x täglich appliziert werden muss, um ausreichende Gewebsspiegel zu gewährleisten.
Ein wesentliches Handicap bei der Antibiose ist die Fähigkeit von Bb in das ZNS einzudringen und sich dort in einem erheblichen Anteil aufzuhalten. Zur Bekämpfung von Bb sind daher Antibiotika einzusetzen, die in das zentrale Nervensystem eindringen können. Diese Eigenschaft wird im Allgemeinen mit sogenannter „Liquorgängigkeit“ gleichgesetzt. Es wird angenommen, dass bei ausreichender Konzentration im Liquor auch ausreichende Konzentrationen im Hirngewebe vorliegen. Entsprechende Studien liegen jedoch nicht vor. Lediglich bei der Meningitis kann aus der Liquorkonzentration auf die Effizienz der Antibiose geschlossen werden. Die Relation zwischen Konzentration im Serum/Liquor ist in Abb. 23.2 für Doxycyclin (vgl. 1, 35) und Tab. 23.16 für weitere Antibiotika dargestellt (vgl. 1). In der Publikation von Dotevall und Hagberg (35) wurden die Konzentration von Doxycyclin nach 5-8-tägiger Behandlung im Serum und Liquor untersucht.


Unterschieden wurden 2 Gruppen entsprechend der täglichen Dosierung von 2 x 100 mg bzw. 2 x 200 mg. Die Konzentration im Serum betrug 4,7 µg/ml bzw. 7,5 µg/ml. Im Serum lagen die Werte bei 0,6 bzw. 1,1 µg/ml. Der MIC wurde mit 0,6-0,7 µg/ml angegeben. Es zeigt sich also, dass in dieser Konstellation eine ausreichende Doxycyclin-Konzentration im Liquor nur bei einer Dosis von 2 x 200 mg erreicht wurde (35).
Bei einer Meningitis ist infolge der gestörten Blut-Liquor-Schranke die Liquorgängigkeit und der meningeale Gewebsspiegel von Antibiotika deutlich erhöht. Dies ist der Grund, warum bei der akuten Lyme-Neuroborreliose, die stets mit einer Meningitis einhergeht, Antibiotika wie Doxycyclin, Penicillin und Carbapeneme wirksam sind. Bei der LB Stadium III ist jedoch eine Meningitis eine Rarität, so dass nur Antibiotika zum Einsatz kommen, die sich bei Patienten ohne Meningitis als ausreichend liquorgängig erwiesen. Dies ist am Beispiel von Doxycyclin in Abb. 23.2 dargestellt. Selbst bei einer Dosierung von 400 mg Doxycyclin/Tag wird keine ausreichende Liquorkonzentration erreicht, wohl aber bei vorliegender Neuroborreliose und der damit einhergehenden Meningitis. Die Liquorgängigkeit verschiedener Antibiotika ist anhand der Serum-/Liquor-Konzentrationen in Tab. 23.16 dargestellt.

Azithromycin hat in diesem Kontext eine Sonderstellung; nach therapieüblicher Dosierung erreichte Azithromycin hohe Konzentrationen im Hirngewebe, war jedoch im Liquor nicht nachweisbar
(2).
Betalactame sind intrazellulär nicht wirksam im Gegensatz zu allen sonstigen bei der LB eingesetzten Antibiotika (vgl. Tab. 23.15). Auch die Down-Regulation von „pore-forming protein“ könnten das
Eindringen von Antibiotika in die Zellmembran von Bb hemmen (3, 4), ein Mechanismus, der sich bei vielen anderen Gramnegativen Bakterien zeigt. Betalactamasen wurden als Ursache der
antibiotischen Resistenz angenommen (5). Bei Betrachtung der Literatur spielt dieser Faktor jedoch bei Bb keine wesentliche Rolle.
Bb hat eine hohe Affinität zu den Molekülen der extrazellulären Matrix (ECM) (25, 26, 27, 28, 29, 30, 31, 32, 33, 34). Die Antibiotika erreichen in der wenig durchbluteten ECM meist keine
ausreichenden Konzentrationen mit der Folge, dass die Antibiotika in diesen Regionen meist wenig wirksam sind.
Unter Einwirkung von Antibiotika entwickelt Bb atypische Formen (Pleomorphie), die auf Antibiotika weniger oder überhaupt nicht ansprechen. Von besonderer Bedeutung in diesem Zusammenhang ist die
Bildung zystischer Formen (Synonym „Blebs“, Listerform (L-Formen), sphäroide Körper, „Round bodies“ (6, 19, 20, 21, 22, 23). Die Entwicklung solcher zystischen Formen ist im Kap. 23.2
(Abwehrmechanismen) dargestellt. Die Zysten sind umgeben von Teilen der Zellwand, tragen also keine Epitope, die sich grundsätzlich nur auf der äußeren Zellmembran befinden. Dennoch sind die
Zysten nicht nur gegen oberflächenaktive Antibiotika (Betalactame) resistent, sondern auch gegen andere Antibiotika mit Einfluss auf die Protein- oder Nukleinsäuresynthese (Tetracycline,
Makrolide). Wirksam gegen Zysten sind lediglich die Nitroimidazole (Tinidazol, Metronidazol), Hydroxychloroquin und Tigecyclin (vgl. Tab. 23.15) (6, 17, 18, 21).
Antibiotika wirken zwar auf spirochätale Formen von Bb, führen jedoch gleichzeitig zur Produktion großer Mengen zystischer Formen. Besonders deutlich wird dieser Vorgang bei Doxycyclin (Abb.
23.3), jedoch auch in erheblichem Ausmaß bei Amoxicillin (Abb. 23.4). In diesem Zusammenhang ist zu beachten, dass die Antibiotika-resistenten Zysten sich unter günstigeren Bedingungen wieder in
normale spirochätale Formen zurückbilden können (20,24). Jedoch sind auch die Zysten infektiös.
Verschiedene Antibiotika haben sehr unterschiedliche Wirkungen auf spirochätale Formen von Bb und auf zystische Formen (Abb. 23.5 und 23.6).




Von besonderer Bedeutung ist in diesem Zusammenhang, dass das Tinidazol in vitro sowohl auf die spirochätale Form als auch auf Zysten hoch wirksam ist und zwar deutlich wirksamer als
Metronidazol. Das ebenfalls sehr wirksame Antibiotikum Tigecyclin kommt wegen erheblicher Nebenwirkungen bei der LB kaum zum Einsatz.
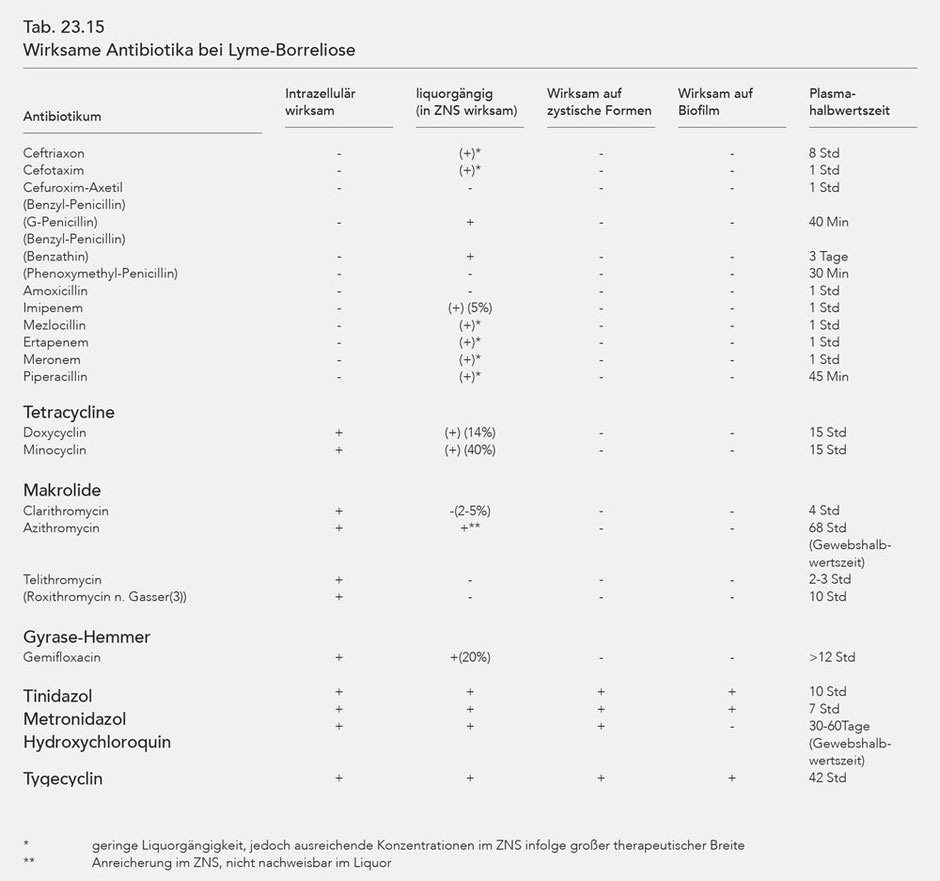
Die Entdeckung der Biofilme geht auf die Arbeitsgruppe von Sapi zurück. Bezüglich der Einzelheiten sei auf das Kap. 23.4 verwiesen. Pauschal kann festgestellt werden, dass Tinidazol die mit
Abstand wirksamste Substanz zur Bekämpfung von Biofilmen ist (Abb. 23.7).
Auch die pflanzlichen Medikamente POA (pentazyklisches Oxindol-Alkaloid (Uncaria tomentosa)) und Otoba (Otoba parvifolia) sind gegen Biofilme sehr wirksam, allerdings nur in Kombination (Abb.
23.8). Zugleich zeigen die Abbildungen, dass zahlreiche Antibiotika, insbesondere auch Tigecyclin, auf die Biofilme eine vergleichsweise geringe Wirkung entfalten.
Die Wirkungsmerkmale verschiedener Antibiotika, also die Effizienz im Hinblick auf die diskutierten Handicaps bei der antibiotischen Behandlung der LB, sind in Tab. 23.17 zusammengefasst.

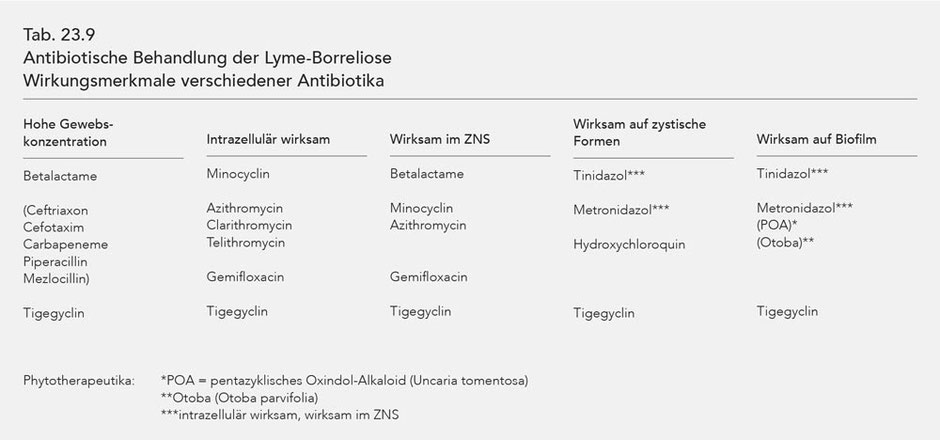
Abgesehen von Tinidazol vermag kein Antibiotikum für sich allein die verschiedenen Handicaps zu überwinden. Da eine Monotherapie in höherer Dosierung mit Tinidazol jedoch nicht möglich ist, ergibt sich als Konsequenz die Notwendigkeit einer synchron kombinierten Antibiose bei der Lyme-Borreliose im Stadium III. Beispiele für eine Kombinationstherapie sind im Kap. 23 dargestellt.
Bei der Lyme-Borreliose im Spätstadium (Stadium III) ist neben der Kombination auch der Zeitfaktor zu beachten, d.h. eine erfolgreiche Behandlung setzt den Einsatz über einen längeren Zeitraum
(mindestens einige Monate) voraus. Bei den aktuell zur Verfügung stehenden Möglichkeiten ist bei der antibiotischen Behandlung der Lyme-Borreliose im Stadium III also eine synchron kombinierte
Langzeitantibiose erforderlich (vgl. Kap. 23.14).
Die Grenzen einer antibiotischen Behandlung wird auch in in-vitro-Untersuchungen deutlich, in denen nur eine Kombination von Antibiotika Bb eradizierte (41).
Ungeklärt bleibt die Erkenntnis, dass eine Lyme-Borreliose im Frühstadium durch Monotherapie für 4 Wochen in über 90% der Fälle beherrschbar ist, während die Monotherapie im Spätstadium eine hohe
Versagerquote aufweist.
- Literaturverzeichnis
-
- Stille W, Brodt H-R, Groll AH, Just-Nübling G. Antibiotika-Therapie, Klinik und Praxis der antiinfektiösen Behandlung. Verlag Schattauer, Stuttgart, New York, 11., komplett aktualisierte und erweiterte Auflage. 2005.
- Jaruratanasirikul S, Hortiwakul R, Tantisarasart T, Phuenpathom N, Russanasunthornwong S. distribution of azithromycin into brain tissue, cerebrospinal fluid, and aqueous humor of the eye. Antimicrob Agents Chemother. 1996; 40(3):825-6.
- Hunfeld KP. Contributions to Seroepidemiology, Diagnosis, and Antimicrobial Susceptibility of Borrelia, Ehrlichia, and Babesia as Indigenous Tick-conducted Pathogens, Shaker Verlag Aachen, Band 2. 2004.
- Kraiczy P. Natürliche Komplementresistenz und humorale Immunabwehr bei Borrelia burgdorferi, dem Erreger der Lyme-Borreliose, Shaker Verlag Aachen, Band 1. 2004.
- Gasser R, Reisinger E, Eber B, Pokan R, Seinost G, Berglöff J, Horwath R, Sedaj B, Klein W. Cases of Lyme borreliosis resistant to conventional treatment: improved symptoms with cephalosporin plus specific beta-lactamase inhibition. Microb Drug Resist. 1995; 1(4):341-4.
- Sapi E, Kaur N, Anyanwu S, Luecke DF, Datar A, Patel S, Rossi M, Stricker RB. Evaluation of in-vitro antibiotic susceptibility of different morphological forms of Borrelia burgdorferi. Infect Drug Resist. 2011; 4:97-113.
- Nanagara R, Duray PH, Schumacher HR Jr. Ultrastructural demonstration of spirochetal antigens in synovial fluid and synovial membrane in chronic Lyme disease: possible factors contribuiting to persistence of organisms. Hum Pathol. 1996; 27(10):1025-34.
- Strle F, Cheng Y, Cimperman J, Maraspin V, Lotric-Furlan S, Nelson JA, Picken MM, Ruzic-Sabljic E, Picken RN. Persistence of Borrelia burgdorferi sensulato in resolved erythema migrans lesions. Clin Infect Dis. 1995; 21(2):380-9.
- Rohacova H, Hancil J, Hulinska D, Mailer H, Havlik J. Ceftriaxone in the treatment of Lyme neuroborreliosis. Infection. 1996; 24(1):88-90.
- Oksi J, Marjamaki M, Nikoskelainen J, Viljanen MK. Borrelia burgdorferi detected by culture and PCR in clinical relapse of disseminated Lyme borreliosis. Ann Med. 1999; 31(3):225-32.
- Hunfeld KP, Ruzic-Sabljic E, Norris DE, Kraiczy P, Strle F. In vitro susceptibility testing of Borrelia burgdorferi sensulato isolates cultured from patients with erythema migrans before and after antimicrobial chemotherapy. Antimicrob Agents Chemother. 2005; 49(4):1294-301.
- Klemann W und Huismans BD. Patienten mit Erreger-Direktnachweis bei chronischer Lyme-Borreliose: Klinik, Labordiagnostik, Antibiotika-Therapie und Krankheitsverlauf – Eine retrospektive Studie. umwelt-medizin-gesellschaft, 22. 2009.
- Nocton JJ, Dressler F, Rutledge BJ, Rys PN, Persing DH, Steere AC. Detection of Borrelia burgdorferi DNA by polymerase chain reaction in synovial fluid from patients with Lyme arthritis. N Engl J Med. 1994; 330(4):229-34.
- Lawrence C, Lipton RB, Lowy FD, Coyle PK. Seronegative chronic relapsing neuroborreliosis. EurNeurol. 1995; 35(2):113-7.
- Bayer ME, Zhang L, Bayer MH. Borrelia burgdorferi DNA in the urine of treated patients with chronic Lyme disease symptoms. A PCR study of 07 cases. Infection. 1996; 24(5):347-53.
- Nocton JJ, Bloom BJ, Rutledge BJ, Persing DH, Logigian EL, Schmid CH, Steere AC. Detection of Borrelia burgdorferi DNA by polymerase chain reaction in cerebrospinal fluid in Lyme neuroborreliosis. J Infect Dis. 1996; 174(3):623-7.
- Brorson O, Brorson SH, Scythes J, MacAllister J, Wier A, Margulis L. Destruction of spirochetes Borrelia burgdorferi round-body propagules (RBs) by the antibiotic tygecycline. Proc Natl Acad Sci. 2009; 106(44):280-284.
- Yang X, Nguyen A, Qiu D, Luft BJ. In vitro activity of tigecycline against multiple strains of Borrelia burgdorfero- J Antimicrob Chemother. 2009; 63(4):709-12.
- Miklossy J, Kasas S, Zurn Ad, McCall S, Yu S, McGeer PL. Persisting atypical and cystic forms of Borrelia burgdorferi and local inflammation in Lyme borreliosis. J Neuroinflammation. 2008; 5:40.
- Mursic VP, Wanner G, Reinhardt S, Wilske B, Busch U, Marget W. Formation and cultivation of Borrelia burgdorferi spheroplast-L-form variants. Infection. 1996; 24(3): 218-226.
- Brorson O und Brorson SH. An in vitro study of the susceptibility of mobile and cystic forms of Borrelia burgdorferi to hydroxychloroquine. Int Microbiol. 2002; 5(1): 25-31.
- Brorson O und Brorson SH, An in vitro study of the susceptibility of mobile and cystic forms of Borrelia burgdorferi to metronidazole. APMIS. 1999; 107(6): 566-76.
- Kersten A, Poitschek C, Rauch S, Aberer E. Effects of penicillin, ceftriaxone and doxycycline on morphology of Borrelia burgdorferi. Antimicrob Agents Chemother. 1995; 39(5):1127-33.
- Brorson O und Brorson SH. In vitro conversion of Borrelia burgdorferi to cystic forms in spinal fluid and transformation to mobile spirochetes by incubation in BSK-H medium. Infection. 1998; 26(3): 144-150.
- Xu H, Raddi G, Liu J, Charon NW, Li C. Chemoreceptors and flagellar motors are subterminally located in close proximity at the two cell poles in spirochetes. J Bacteriol. 2011;193(10):2652–2656.
- Zhang K, Liu J, Tu Y, Xu H, Charon NW, Li C. Two CheW coupling proteins are essential in a chemosensory pathway of Borrelia burgdorferi. Mol Microbiol. 2012; 85(4):782–794.
- Sze CS, Zhang K, Kariu T, Pal U, Li C. Borrelia burgdorferi needs chemotaxis to establish infection in mammals and to accomplish its enzootic cycle. Infect Immun. 2012; 80(7):2485–2492.
- Parveen N und Leong JM. Identification of a candidate glycosaminoglycan-binding adhesin of the Lyme disease spirochete Borrelia burgdorferi. Mol Microbiol. 1998; 35(5):1220–1234.
- Guo BP, Brown EL, Dorward DW, Rosenberg LC, Höök M. Decorin-binding adhesins from Borrelia burgdorferi. Mol Microbiol. 1998; 30(4):711–723.
- Probert WS und Johnson BJ. Identification of a 47 kDafibrinonectin-binding protein expressed by Borrelia burgdorferi isolate B31. Mol Microbiol. 1998; 30(5):1003–1015.
- Barthold SW, Hodzic E, Tunev S, Feng S. Antibody-mediated disease remission in the mouse model of lyme borreliosis. Infect Immun. 2006; 74(8):4817-4825.
- Zambrano MC, Beklemisheva AV, Bryksin AV, Newman SA, Cabello FC. Borrelia burgdorferi binds to, invades, and colonizes native type I collagen lattices. Infect Immun. 2004; 72(6):3138-3146.
- Barthold SW, de Souza MS, Janotka JL, Smith AL, Persing DH. Chronic Lyme borreliosis in the laboratory mouse. Am J Pathol. 1993; 143(3):959-971.
- Cabello FC, Godfrey HP, Newman SA. Hidden in plain sight: Borrelia burgdorferi and the extracellular matrix. Trend Microbiol. 2005; 15(8):350-354.
- Dotevall L und Hagberg L. Penetration of doxycycline into cerebrospinal fluid in patients treated for suspected Lyme neuroborreliosis. Antimicrob Agents Chemother. 1989; 33(7):1078-80.
- Sapi E, Kaur N, Anyanwu S, Luecke DF, Datar A, Patel S, Rossi M, Stricker RB. Evaluation of in-vitro antibiotic susceptibilitiy of different morphological forms of Borrelia burgdorferi. Infection and Drug Resistance. 2011; 4:97-113.
- Brisson D, Drecktrah S, Eggers CH, Samuels DS. Genetics of Borrelia burgdorferi. Annu. Rev. Genet. 2012; 46:515-36.
- HunfeldKP und Brade V. Antimicrobial susceptibility of Borrelia burgdorferi sensulato: what we know, what we don‘t know, and what we need to know. Wien KlinWochenschr. 2006; 118(21-22):659-68.
- Lomovskaya O und Totrov M. Vacuuming the Periplasm. Journal of Bacteriology. 2005; 1879-1883.
- Datar A, Kaur N, Patel S, Luecke DF, Sapi E. In Vitro Effectiveness of Samento and Banderol Herbal Extracts on the Different Morphological Forms of Borrelia Burgdorferi. Townsend Letter, The Examiner of Alternative Medicine. 2010.
- Feng J, Auwaerter PG2, Zhang Y. Drug combinations against Borrelia burgdorferi persisters in vitro: eradication achieved by using daptomycin, cefoperazone and doxycycline. PLoS One. 2015; 10(3):e0117207.